AG Sabine Müller
 |
Molekulare Mechanismen der zellulären Morphogenese
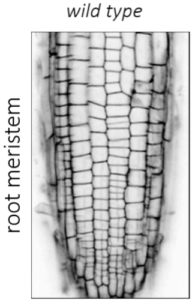
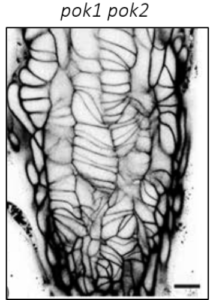
Die Kontrolle der Zellmorphologie ist eine grundlegende Eigenschaft des Lebens, die für die Form und Funktion aller Organismen wesentlich ist. Die Orientierung der Zellteilung und der polarisierten Zellexpansion sind die Schlüsseldeterminanten der zellulären Morphogenese und bilden die Voraussetzungen für die dreidimensionale Organentwicklung, für Gewebefunktionalität und die Anpassungen an sich ändernde Umweltbedingungen. Die Zellform wird direkt oder indirekt von einer internen Gerüststruktur, dem Zytoskelett bestimmt. Das sich dynamisch reorganisierende Zytoskelett ist ein wichtiger Akteur der Zellteilung (Abbildung 1 und Videos) und des Zellwachstums indem es Teilungsebenen fixiert, Chromosomen trennt, und den gezielten Vesikeltransport während Zellteilung und während anisotropen und multipolaren Wachstums unterstützt. Meine Arbeitsgruppe verwendet das Wurzelmeristem und die Blattepidermis der Modellpflanze Arabidopsis thaliana als experimentelle Systeme, um molekulare Mechanismen zu untersuchen, die an der zellulären Morphogenese beteiligt sind. Wir verwenden eine synergistische Kombination aus Molekulargenetik und Live-Imaging, um Form-gebende Prozesse zu untersuchen. Dieser Ansatz ermöglichte die Identifizierung und Charakterisierung neuer Mechanismen, die den komplexen und mehrstufigen Prozessen zugrunde liegen, welche Zytoskelettproteinen und relevanten Signalkomplexen mit Zellform und in weiterer Folge mit der Pflanzenentwicklung verknüpfen.
 |
 |
||
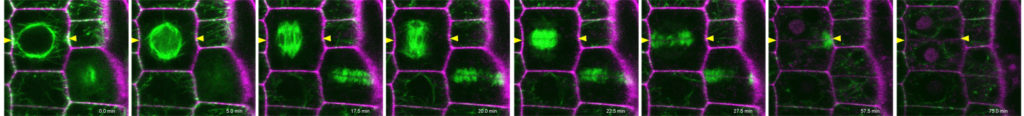
| Abbildung 1: Zellorganisation und Zellteilung (Videos: grün Microtubuli, magenta Zellwand, Pfeilköpfe: Präprophaseband) des Arabidopsis-Wurzelmeristems im Wildtyp und in der Doppelmutante von Kinesin 12 pok1pok2. | |||
Die Teilungsebene und die Rolle von Kinesin-12-Motorproteinen
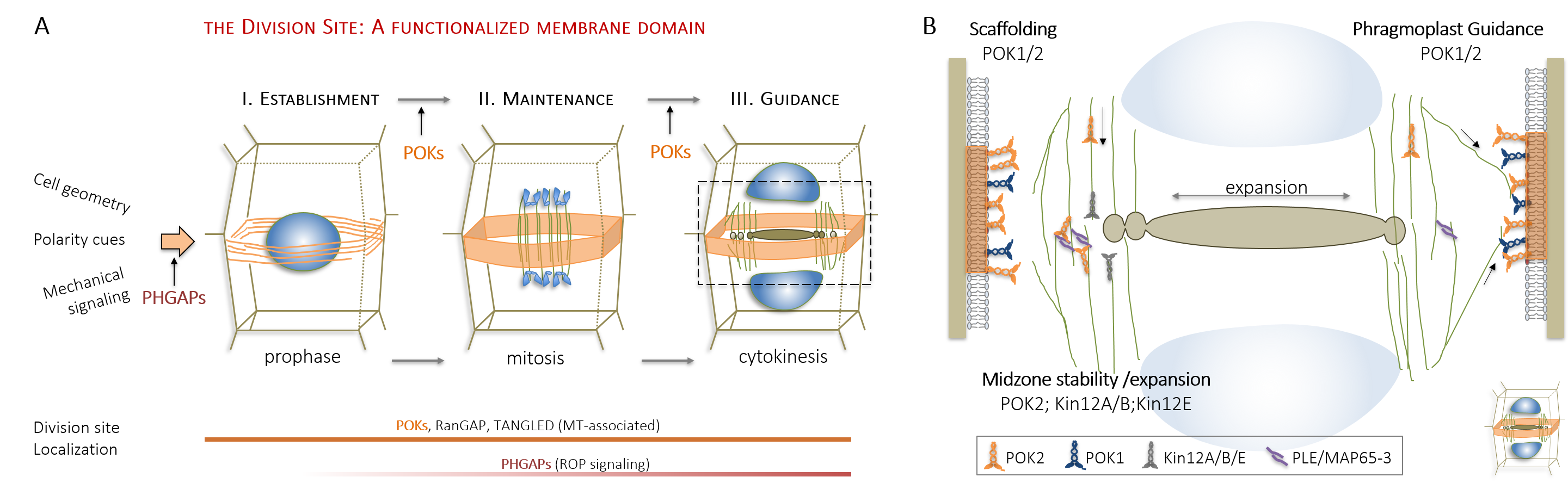
Die Forschung meiner Arbeitsgruppe hat wesentlich zum Verständnis der Orientierung der Teilungsebene, eine Frage, die Wissenschaftler seit dem 19. Jahrhundert beschäftigt, beigetragen. Unter Verwendung moderner bildgebender Verfahren haben wir die raum-zeitliche Dynamik des Arabidopsis-Kinesin-12-Klasse PHRAGMPOLAST ORIENTING KINESIN (POK) 1 Motorproteins während der Zellteilung charakterisiert. Durch die Kombination von Bildgebung mit Molekulargenetik konnten wir mit unserer Forschung die wesentliche Rolle von Kinesin POK1 und seinem nahen Verwandten POK2 nachweisen. Diese Proteine dienen als Schlüsselkomponenten der Teilungszone (division site), einer polarisierten Plasmamembranregion, die die Teilungsebene während der gesamten Zellteilung vorhersagt und bewahrt (Abbildung 2A , Lipka et al., 2014, Livanos und Müller, 2019). Die Analyse von raum-zeitlichen Lokalisierungsmustern, sowie biochemischen und genetischen Interaktionsassays zeigten die Funktion von POK-Kinesinen als Gerüst, welches einige am Ort der Teilung ansässige Proteine unterstützt. Außerdem haben wir ihre Bedeutung für die Phragmoplastenleitung aufgezeigt und den Beitrag von POK2 zur Phragmoplastenstabilität und -expansion über zwei separate Bindungsdomänen mit unterschiedlichen Bindungsspezifitäten für verschiedene Mitglieder des Mikrotubuli-Vernetzers MAP65 nachgewiesen (Abbildung 2B, Herrmann et al., 2018).
 |
|
| Abbildung 2: Etablierung der Teilungszone (cortical division site) und Phragmoplastenleitung. (A) Am Ort der Teilung ansässige Proteine während der Zellteilung. (B) Unterschiedliche Funktionen der Kinesin-12 Familie während der Zytokinese. |
Zukünftige Forschungsrichtungen:
Molekulare Mechanismen der Phragmoplastenleitung
Charakterisierung POK-assoziierter Proteinkomplexe
Evolution der Kinesin-12-abhängigen Phragmoplastenleitung und der Teilungszone
Erweiterung des Interaktoms an der kortikalen Teilungszone
Funktion von ROP-vermittelter Zellpolarität und die Teilungssymmetrie von Pflanzenzellen
Forschung und Signifikanz: Mit unserer bisherigen Arbeit haben wir neue Interaktoren von POK1/2, die als PHGAPs/RENs bezeichnet werden, identifiziert und charakterisiert. Diese Proteine gehören zu einer Familie von GTPase-aktivierenden Proteinen (GAP), die die Zellpolaritäts-Signalmoleküle Rho-Verwandte von Pflanzen (ROP) deaktivieren. PHGAPs reichern sich nach der Prophase in Abhängigkeit der POKs an der Teilungsstelle/zone an (Abbildung 2A, Stöckle et al., 2016). Die Analyse des Zytoskeletts im phgap1phgap2 Wurzelmeristem wies auf Fehler bei der Auswahl der Teilungsebene während der Prophase hin, die auch die POK-Lokalisierung beeinflussten. Zusammenfassend legte diese Arbeit nahe, dass Zellpolaritätssignale die Auswahl der Teilungsebene nicht nur in asymmetrisch, sondern auch in symmetrisch teilenden Zellen des Wurzelmeristems beeinflussen.
(1) Regulierung der PHGAP-Lokalisation an der Teilungszone.
(2) Etablierung der Aktin-reduzierten Zone (Actin Depleted Zone).
Evolution der Kinesin-12-Funktionen
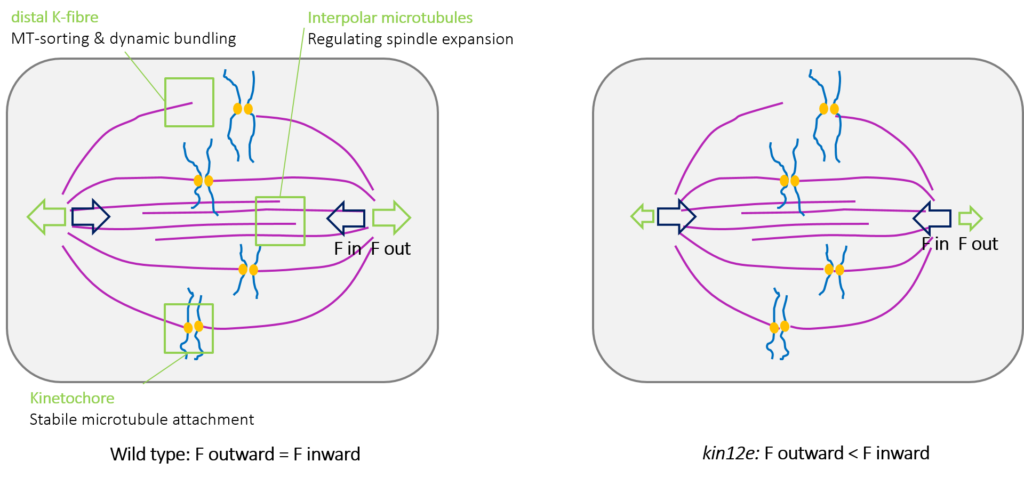
Forschung und Signifikanz: Die bipolare mitotische Spindel ist eine hochkonservierte Struktur unter Eukaryoten, die die Chromosomenorientierung und -segregation vermittelt. Die Formierung der mitotischen Spindel und deren Größenkontrolle werden von krafterzeugenden Mikrotubuli-abhängige Kinesinen unterstützt. Arabidopsis KINESIN-12E agiert während der Formierung der Spindel. In kinesin-12e Mutanten gehen eine Verzögerung des Spindelaufbaus mit einer Verringerung der Spindelgröße einher (Abbildung 3), was zeigt, dass KINESIN-12E zur mitotischen Spindelarchitektur beiträgt. Änderungen der Prophase- und Metaphase-Spindel- und Kinetochor-Dynamik in Abwesenheit von KINESIN-12E deuten darauf hin, dass es während der Formierung der mitotischen Spindel eine evolutionär konservierte Rolle spielen könnte, ähnlich wie seine spindellokalisierten tierischen Kinesin-12-Orthologen.
 |
|
| Abbildung 3: Kinesin-12E reguliert die Spindelgröße. Vom Spindelpol zur Zellperipherie gerichtete Kräfte (F outward) sind in der kin12e Mutante reduziert. |
Etablierung von Zellpolarität während der Entwicklung von Pflasterzellen
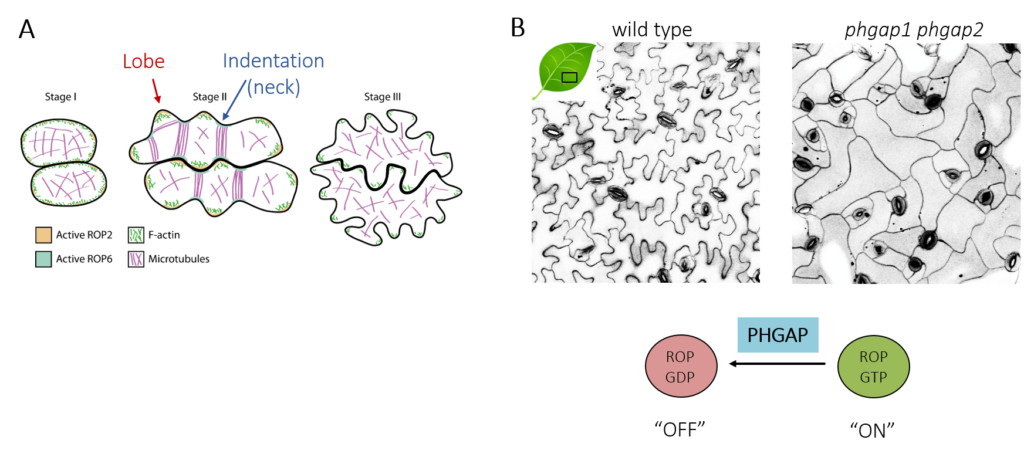
Laufende & zukünftige Forschung: Neben der Zellteilung sind PHGAPs an der Etablierung der Zellpolarität in multipolaren Pflasterzellen der Blattepidermis beteiligt. Diese Zellen haben eine komplizierte ineinandergreifende Form (Abbildung 4A), von der angenommen wird, dass sie die mechanische Belastung im Gewebe reduziert. Die Entwicklung von Pflasterzellen beinhaltet eine iterative Rückkopplung zwischen Mikrotubuli, die lokale Zellwandablagerung steuern, um dem Turgordruck und der anisotropen Zellexpansion zu widerstehen, die wiederum auf die Verteilung der Mikrotubuli zurückwirken. Zudem modeliert der mechanische Stress, der während dieses rekursiven Prozesses entsteht, das zelluläre Verhalten weiter.
PHGAP agiert während der Entwicklung von Pflasterzellen. Die Komplexität der Pflasterzellform geht in phgap1phgap2 Doppelmutanten verloren, wodurch ihre Funktion innerhalb des ROP-Signalwegs angesiedelt wurde (Abbildung 4B, Lauster et al., 2022). Eine weitere Charakterisierung von Mutanten mit veränderter Pflasterzellmorphologie, unter Verwendung moderner bildgebender Verfahren soll die PHGAP-Dynamik aufklären, um den Beitrag der PHGAP-Polarisation zur Zellmorphogenese zu bestimmen. Diese Arbeiten werden klären, wie differentielle PHGAP-Aktivitäten die multipolare Formbildung feinabstimmen.
 |
|
| Abbildung 4: Entwicklung von Pflasterzellen (modifiziert nach Craddock et al., 2012). (A) Die Koordination von ROP-Aktivitäten und Organisation des Zytoskeletts sind für die Zellform entscheidend. (B) Form der Blattepidermis-Pflasterzellen und Regulierung der ROP-Signalleitung. |
Mitarbeiter
Dr. Pantelis Livanos
Choy Kriechbaum (Doktorandin)
Jennifer Schuster (TA)